A doença de Parkinson (DP) é a segunda doença neurodegenerativa mais comum e de crescimento mais rápido no mundo. Afeta 2 a 3% dos indivíduos com mais de 65 anos, um número que deverá duplicar até ao ano 2040.
Sintomas da doença de Parkinson
Tremores e bradicinesia (dificuldade ou lentidão na realização de movimentos voluntários)
Distúrbios do sono
Disfunção cognitiva
Assim como o Alzheimer e outras doenças neurodegenerativas, a DP é biologicamente caracterizada pelo enrolamento incorreto de proteínas e pela morte desenfreada de neurônios. Na DP a agregação da proteína α-sinucleína está ligada à morte de neurônios dopaminérgicos na substância negra (SN) do mesencéfalo.
Como substrato combustível a molécula sinalizadora, β-hidroxibutirato (βHB) pode ajudar a retardar, interromper ou até mesmo reverter a progressão da DP. O βHB protege com sucesso os neurônios dopaminérgicos e alivia os sintomas da DP.
Benefícios do βHB para o cérebro:
(i) maior produção de ATP;
(ii) aumento das defesas antioxidantes;
(iii) um ativador da proteína G acoplada, receptor 2 de ácido hidroxicarboxílico (HCAR2);
(iv) inibidor de histona desacetilases (HDACs).
Metabolismo Energético Anormal em neurônios dopaminérgicos
Devido ao seu grande tamanho, extensa arborização e atividade estimuladora de cálcio, os neurônios dopaminérgicos são células particularmente ativas do ponto de vista metabólico, sendo especialmente suscetíveis à privação de energia. Os níveis de ATP no cérebro são significativamente reduzidos em pacientes com DP.
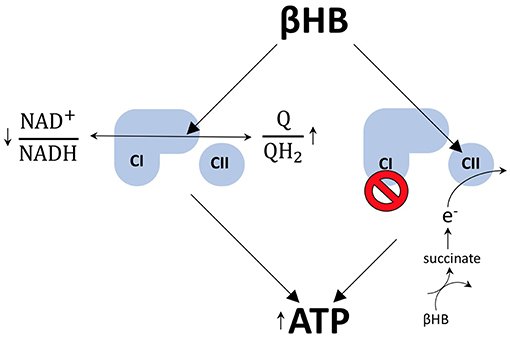
Existem pelo menos dois mecanismos pelos quais o βHB pode aumentar os níveis de ATP nos neurônios dopaminérgicos. Primeiro, exercendo efeitos redox opostos nos transportadores de elétrons da cadeia respiratória, NAD e coenzima Q (Q). Ao reduzir (diminuir) a razão NAD+/NADH, ao mesmo tempo que oxida (aumenta) a razão Q/QH2, o βHB aumenta a diferença entre os potenciais redox destes dois pares de transportadores de elétrons.
Quando os elétrons são transmitidos do NADH para o Q, mais prótons podem ser bombeados para o espaço intermembranar para impulsionar a geração de mais ATP por quimiosmose. Desta forma, o metabolismo do βHB pode aumentar a amplitude redox dentro da cadeia de transporte de elétrons para aumentar a geração de ATP por fosforilação oxidativa.
O metabolismo do βHB também permite que os neurônios dopaminérgicos contornem o bloqueio do complexo I da cadeia transportadora de elétrons, um fenômeno que contribui para a disfunção mitocondrial na doença de Parkinson. A etapa limitante da taxa do catabolismo do βHB gera succinato, o combustível oxidativo do complexo II. A administração exógena de βHB a camundongos com DP protege os neurônios dopaminérgicos da morte celular.
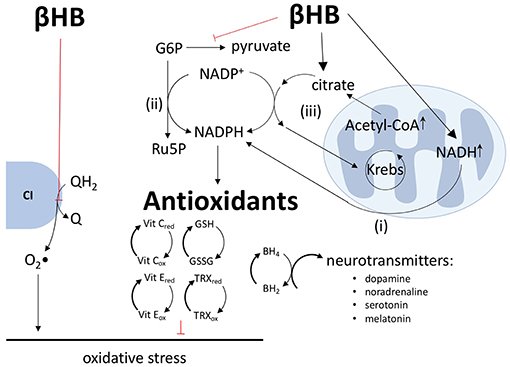
Ao alterar as proporções de pares redox nas mitocôndrias e no citoplasma, o metabolismo do βHB pode diminuir a produção de espécies reativas de oxigênio (EROs) e reforçar as defesas antioxidantes. A maioria das EROs mitocondriais são geradas através do processo de transporte reverso de elétrons, no qual os elétrons são passados de QH2 para o oxigênio no complexo I para gerar superóxido.
Além de aumentar a relação Q/QH2 e diminuir a relação NAD+/NADH, o βHB também diminui a relação NADP+/NADPH através de uma variedade de mecanismos. Primeiro, o NADH e o NADPH estão fortemente ligados, especialmente nos neurônios, pela transferência direta de íons hidreto do NADH para o NADP+ via nicotinamida nucleotídeo transidrogenase.
Em segundo lugar, ao diminuir o fluxo glicolítico, o βHB força a glicose-6-fosfato a descer a via das pentoses fosfato, levando à produção de dois equivalentes de NADPH (8, 12–14). Terceiro, ao aumentar cerca de 15 vezes a concentração de acetil-CoA mitocondrial, o βHB aumenta a concentração de citrato mitocondrial e a exportação deste citrato para o citoplasma pelos ciclos citrato-piruvato e citrato-isocitrato, cada um dos quais inclui uma etapa de redução de NADP+ para NADPH catalisada pela enzima málica e isocitrato desidrogenase, respectivamente. Os produtos desses dois sistemas transportadores, oxaloacetato e α-cetoglutarato, retornam ao ciclo de Krebs para completar o circuito. Portanto, ao aumentar as concentrações de citrato mitocondrial, o βHB força as rodas citrato-piruvato e citrato-isocitrato a girar mais rápido para produzir mais NADPH.
Como todos os antioxidantes intracelulares conhecidos, direta ou indiretamente, dependem do NADPH como doador de elétrons, a redução de NADP+ em NADPH mediada por βHB se traduz em um aumento nos níveis reduzidos de glutationa, tiorredoxina, vitaminas C e E e outros antioxidantes essenciais.
Ao aumentar os níveis de NADPH, o βHB pode exercer outro efeito benéfico no contexto da DP: o βHB pode aumentar a síntese de dopamina e outros neurotransmissores. Como agente redutor final, o NADPH apoia a redução da di-hidrobiopterina em tetra-hidrobiopterina, uma coenzima crítica na síntese de dopamina, noradrenalina, serotonina e melatonina.
Ativação do receptor acoplado à proteína G (HCAR2)
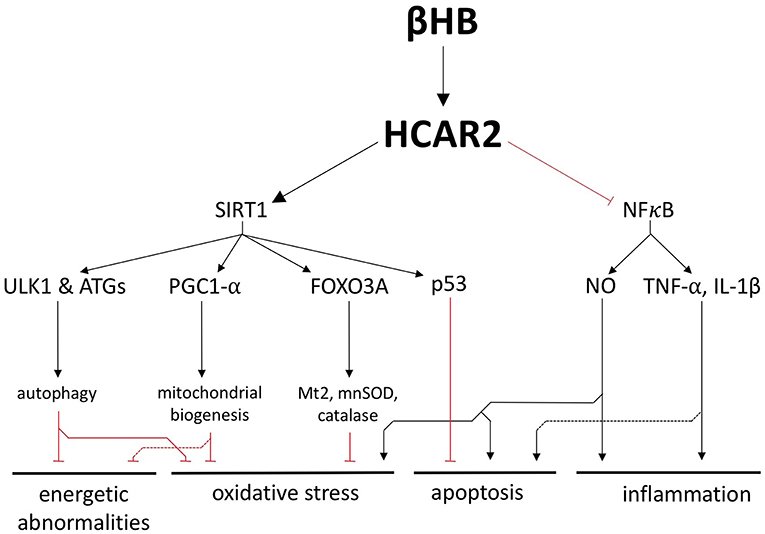
Além de seu papel como substrato combustível, o βHB é um ligante para o receptor 2 do ácido hidroxicarboxílico (HCAR2), um receptor acoplado à proteína G que é regulado positivamente no SN de pacientes com DP. Ao substituir a niacina e ativar o HCAR2, o βHB pode ser capaz de atingir um conjunto de vias sensibilizadas no cérebro com DP, vias que incluem as proteínas críticas SIRT1 e NFκB.
SIRT1 é uma desacetilase cuja atividade está fortemente associada aos benefícios genéricos de saúde e longevidade da restrição calórica. Acredita-se que uma forma pela qual a SIRT1 medeie seus benefícios neurológicos é regulando positivamente a autofagia, um processo catabólico ativo em todas as células que facilita a degradação e a reciclagem de componentes celulares danificados.
De forma complementar, a SIRT1 ativa o regulador mestre da biogênese mitocondrial, PGC1-α, que também é subexpresso e tem sido fortemente implicado na patogênese da DP. A SIRT1 não só pode aumentar a autofagia e a biogênese mitocondrial, mas também induz a expressão dependente de FOXO3A dos genes antioxidantes catalase, mnSOD e Mt2.
Portanto, a estimulação da SIRT1 pelo βHB poderia proteger as células contra o esgotamento energético e o estresse oxidativo, melhorando a saúde do pool mitocondrial e reforçando as defesas antioxidantes.
Ao ligar-se ao HCAR2 em macrófagos e microglia no cérebro, o βHB também inibe a neuroinflamação mediada por NFκB, uma característica patológica crítica na DP. O NFκB é um potente fator de transcrição pró-inflamatório que está elevado no cérebro da DP. Além de estimular uma resposta imune inata no cérebro, as citocinas TNF-α e IL-1β, que também foram propostas como alvos para potenciais tratamentos de DP (34), também podem promover diretamente a apoptos.
O NO gerado pela iNOS, que também é patologicamente importante na DP é também uma molécula pró-inflamatória. O NO pode bloquear a recaptação de glutamato, levando à excitotoxicidade e apoptose. O NO também pode provocar estresse oxidativo pela modificação pós-tradução de proteínas importantes no controle de qualidade mitocondrial e pode induzir estresse nitroxidativo combinando-se com superóxido para formar peroxinitrito e outras moléculas citotóxicas.
Inibição de Histona Desacetilase
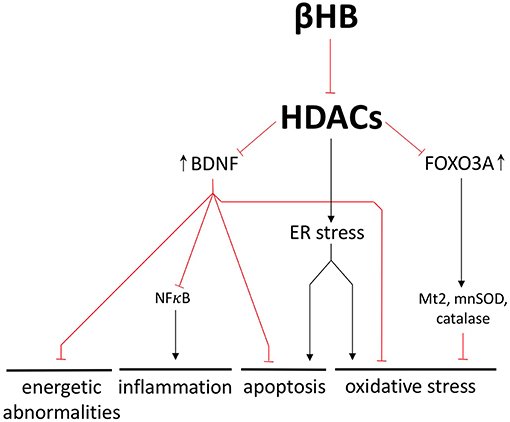
A inibição da histona desacetilase (HDAC) diminui a toxicidade da α-sinucleína e protege os neurônios dopaminérgicos da morte celular. Como um inibidor natural das HDACs 1, 3 e 4, o βHB pode controlar cada uma das patologias subjacentes à DP, regulando as HDACs e alterando a expressão genética.
Por exemplo, a inibição de HDAC mediada por βHB aumenta a expressão do fator neurotrófico derivado do cérebro (BDNF), uma molécula conhecida por sua suposta capacidade de estimular a neurogênese adulta. Em pacientes com DP, a expressão de BDNF no SN está significativamente diminuída. Aumentar o BDNF é importante pois também previne a neuroinflamação e a apoptose mediada por NFκB. Finalmente, o BDNF aumenta a atividade de múltiplas enzimas antioxidantes e diminui o dano oxidativo nos gânglios da base.
O BDNF é um exemplo representativo de como a inibição de HDAC mediada por βHB pode exercer uma ampla gama de efeitos neuroprotetores alterando a transcrição.
O eBook acima está disponível exclusivamente nos cursos: